e-RMP Update(RMP情報提供サービス)
RMP一覧更新情報
2026年1月に新規追加された製品
(PMDAメディナビ「医薬品リスク管理計画(RMP)掲載のお知らせ」の月末配信日時点までに新規追加されたRMPを対象とする。
- アップニーク
- アバレプト
- イセルティ
- イムルリオ
- ウステキヌマブ「ニプロ」
- エキシデンサー
- エクテリー
- エルゾンリス
- ザズベイ
- ジニイズ
- セピエンス
- プリミーフォート
- ボルテゾミブ「NK」
- ミンジュビ
- ラヴィクティ
- リブロファズ
2026年1月末時点で、626製品(568成分)のRMPがPMDAのサイトに掲載・公開されています。
詳細はRMP一覧をご確認ください。(今回更新された箇所:赤字、過去に更新された箇所:青字、更新なし:黒字)
掲載ファイルは毎月1回更新しております。
pdf形式での掲載のため、利用者の皆様にはご不便おかけいたしますが、何卒ご理解のほど宜しくお願い致します。
有償になりますがExcelファイルやpptxファイルでのご提供も承っております。ご希望の方はフォームよりお問い合わせください。
月1回の更新のタイミングでプッシュメールでの通知をご希望の方は、下記メールアドレスへ、社名・氏名・メールアドレスをご連絡ください。
製造販売後データベース調査・製品一覧
全成分集計結果
RMP一覧
有償になりますが、薬効群ごとにソートした結果(サンプルファイル参照)をご提供可能です。ご希望の方はフォームよりお問い合わせください。
RMP削除製品一覧
お問い合わせはこちら
RMPとは
RMPとは、「医薬品リスク管理計画(RMP:Risk Management Plan)」を指します。厚生労働省は、2013年4月1日から、新医薬品とバイオ後続品の承認申請の資料として「医薬品リスク管理計画(RMP:Risk Management Plan)」の提出を製薬企業に義務づけました。「医薬品リスク管理計画(RMP)」の作成指針と記載形式は、2012年4月に通知されています。RMPは、基本的に3つの要素(「安全性検討事項」「医薬品安全性監視計画」「リスク最小化計画」)から構成されます。また、必要に応じて有効性に関する調査・試験の計画が加わることがあります。これら計画の全体を取りまとめ文書化したものがRMPです。
RMPが作成され、公表される医薬品の範囲
医薬品は、有効性とともに一定のリスク(副作用)を伴うものであり、リスクをゼロにすることはできませんが、これを可能な限り低減するための方策を講じ、適切に管理していくことが重要です。医薬品の安全性を確保するためには、開発の段階から承認審査を経て製造販売後に至るまで、常に医薬品のリスクを適切に管理する方策を検討することが重要です。RMPは、現在行われているこれらの取り組みを医薬品ごとに文書化し、医療関係者の皆様、行政、製薬企業など医薬品の適正使用に関わるすべての関係者で共有できるようにすることで、市販後安全対策の一層の充実強化を図ることを目的とするものです。RMPの対象となる医薬品は、医療用医薬品です。これには、新医薬品、バイオ後続品、後発医薬品が含まれますが、一般用医薬品には適用されません。適用時期は、新医薬品、バイオ後続品は2013年4月以降に承認申請される品目から適用されます。また後発医薬品に関しても、RMPの作成と公表が承認条件として、新医薬品と同様に義務づけられます。さらに、2013年4月以降、市販後に新たな安全性の懸念が判明した医療用医薬品も対象となることから、既存の医薬品でも緊急安全性情報(イエローレター)、安全性速報(ブルーレター)などが出された場合など、重大な安全性の懸念が判明した時には対象となる可能性があります。
RMPの3つの要素
RMPは、基本的に3つの要素(「安全性検討事項」「医薬品安全性監視計画」「リスク最小化計画」)から構成されます。また、これらに加え、必要に応じて有効性に関する調査・試験の計画を作成することが求められます。これら計画の全体を取りまとめ文書化したものがRMPです。
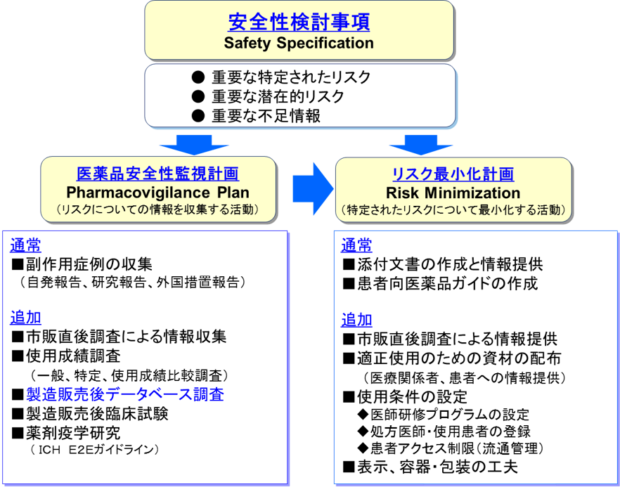
安全性検討事項とは
「安全性検討事項」とは、開発段階で得られた情報や市販後の副作用報告などから明らかとなったリスクのうち、医薬品のベネフィット・リスクバランスに影響を及ぼしうる、又は保健衛生上の危害の発生・拡大のおそれがあるような重要な事項のことです。安全性検討事項を特定することは、その医薬品の安全対策を検討し、実行するうえでとても重要なことですので、これがRMPの出発点になります。「安全性検討事項」の内訳は、「重要な特定されたリスク」、「重要な潜在的リスク」、「重要な不足情報」です。
 (出典:日本製薬工業協会 医薬品評価委員会 PMS部会編「医薬品リスク管理計画について(Risk Management Plan,RMP)」(医療関係者向け説明資料),2013年8月より作成)
(出典:日本製薬工業協会 医薬品評価委員会 PMS部会編「医薬品リスク管理計画について(Risk Management Plan,RMP)」(医療関係者向け説明資料),2013年8月より作成)
「重要な特定されたリスク」は、すでに医薬品との関連性がわかっているリスク(臨床試験において本剤群で有意に発現している副作用や多くの自発報告があり、時間的関連性等から因果関係が示唆される副作用)のうち重要なものです。「重要な潜在的リスク」は、関連性が疑われるものの十分に確認されていないリスク(薬理作用等から予測されるが、臨床的には確認されていない副作用や同種同効薬で認められている副作用)のうち重要なものです。「重要な不足情報」は、安全性を予測するうえで重要ではあるが十分でない情報(治験対象から除外されているが実地医療では高頻度で使用が想定される患者集団(高齢者、腎機能障害患者、肝機能障害患者、妊婦、小児など)における安全性情報)です。それぞれ、「重要な」が頭につくことがポイントです。「重要な」とは、ヒトに発現した場合に重篤である、又は高頻度に発現する等の理由から、当該医薬品のベネフィット・リスクバランスに影響を及ぼしうる、又は保健衛生上の危害の発生若しくは拡大のおそれがあるものを指します。そのため、必ずしも添付文書の記載事項すべてが記載されるわけではありません。また「重大な副作用」の項に記載されていても、RMPの安全性検討事項にならない場合もあります。
医薬品安全性監視計画とは
「医薬品安全性監視計画」とは、特定した安全性検討事項に基づき、どのような監視活動(医薬品安全性監視活動)を行っていくかを計画するものです。「医薬品安全性監視計画」はファーマコビジランスプラン(Pharmacovigilance Plan)の日本語訳で、ファーマコビジランスはWHOの定義で「医薬品の有害作用又は関連する諸問題の検出、評価、理解及び防止に関する科学及び活動」とされています。医薬品安全性監視活動には、「通常の医薬品安全性監視活動」と「追加の医薬品安全性監視活動」の2つの活動が含まれます。
 (出典:日本製薬工業協会 医薬品評価委員会 PMS部会編「医薬品リスク管理計画について(Risk Management Plan,RMP)」(医療関係者向け説明資料),2013年8月より作成)
(出典:日本製薬工業協会 医薬品評価委員会 PMS部会編「医薬品リスク管理計画について(Risk Management Plan,RMP)」(医療関係者向け説明資料),2013年8月より作成)
「通常の医薬品安全性監視活動」は、全ての医薬品において通常行われる活動で、副作用症例や文献情報等の収集に関する活動です。「追加の医薬品安全性監視活動」は、医薬品の特性等を踏まえ、必要に応じて通常の活動に追加して行われる活動です。追加の監視活動にはいくつかの種類があります。
追加の監視活動の例
- 市販直後調査による重篤な副作用収集
- 使用成績調査(一般使用成績調査、特定使用成績調査、使用成績比較調査)
- 製造販売後データベース調査
- 製造販売後臨床試験
- 薬剤疫学研究
リスク最小化計画とは
「リスク最小化計画」とは、医薬品の承認時までに得られた情報及び当該医薬品の製造販売後に医薬品安全性監視活動により収集された安全性等に関する情報並びにそれらの情報の評価に基づき、当該医薬品のリスクを最小に抑え、ベネフィット・リスクバランスを適切に維持するために実施する個々のリスク最小化活動の全般を束ねた行動計画のことです。
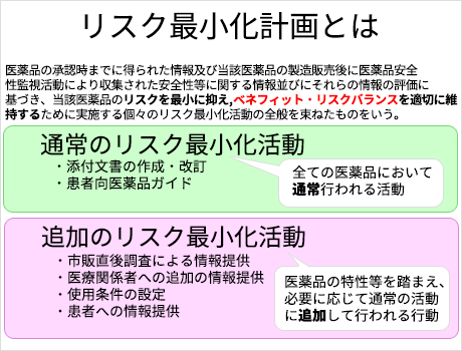 「医薬品安全性監視計画」と同様に、「リスク最小化活動」にも、「通常のリスク最小化活動」と「追加のリスク最小化活動」があります。
「医薬品安全性監視計画」と同様に、「リスク最小化活動」にも、「通常のリスク最小化活動」と「追加のリスク最小化活動」があります。
(出典:日本製薬工業協会 医薬品評価委員会 PMS部会編「医薬品リスク管理計画について(Risk Management Plan,RMP)」(医療関係者向け説明資料),2013年8月より作成)
「通常のリスク最小化活動」は全ての医薬品において通常行われる活動で、添付文書の作成・改訂およびこれに伴う使用上の注意改訂のお知らせ文書の配布、患者向医薬品ガイドによる情報提供が含まれます。新薬発売後、一定期間配布する「新医薬品の使用上の注意の解説」による情報提供も通常の活動です。「追加のリスク最小化活動」は、当該医薬品の特性等を踏まえ、必要に応じて追加して行われる活動で、いくつかの種類があります。以下は追加のリスク最小化活動の例です。
リスク最小化活動の例
- 市販直後調査による情報提供
- 医療関係者への追加の情報提供
- 患者への情報提供
- 使用条件の設定
安全性検討事項/RMPの見直し
RMPは医薬品のライフサイクルに渡って行う活動ですので立案を起点として計画どおり実行し、PDCAサイクルと同じく運用しながら改善していく必要があります。製造販売後の医薬品安全性監視活動の結果として、新たな安全性の懸念が判明したときは、速やかに安全性検討事項を見直す必要があります。安全性検討事項を変更するときは、RMPの改訂が必要であり、使用成績調査の実施要綱やリスク最小化のための資材など関連文書を改訂するなど必要な措置をとります。このように、RMPは一度策定すれば終わりというものではなく、市販後に得られた新たな安全性・有効性の情報に基づき常に見直しを行う必要があります。そしてRMPは、医薬品のライフサイクルの中で計画の策定、実施、評価、見直しが継続して行われていくことになります。
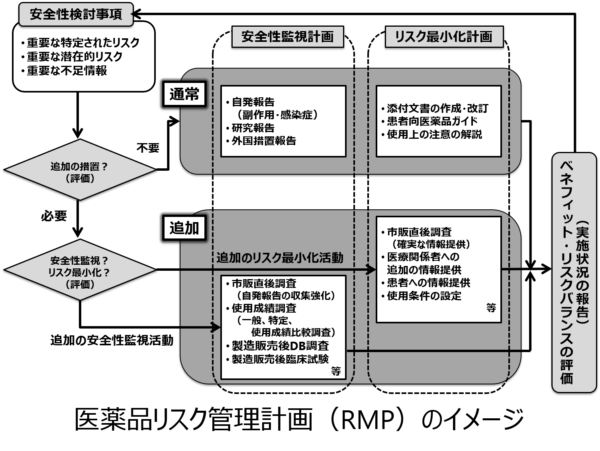 医薬品リスク管理計画(RMP)のイメージ
医薬品リスク管理計画(RMP)のイメージ
(出典:北島行雄、医薬品における製造販売後安全管理対応、情報機構、第3章、P36、2018年より作成)
