安全性情報対応
経験豊富な専門スタッフが迅速かつ的確にサポートします。
安全性情報対応業務では、治験、製造販売後調査・試験、自発報告、文献学会報告、海外からの有害事象報告等の各種情報源から収集された安全性情報をデータベースに入力、一次処理(一次評価)して、必要に応じて医療機関への再調査(案)、医薬品医療機器総合機構(PMDA)への報告書(案)を作成します。また、治験・製造販売後臨床試験においては治験責任医師および実施医療機関の長に提出する文書(案)を作成・伝達します。
EPSの特徴
フルサポート
英語力のある経験者が、日本国内はもちろん海外業務もフルサポートで支援しています。
有害事象の判断力
判断の難しい有害事象について、イーピーエス内の医学専門家及び契約している外部医学専門家によるコンサルティングを提供します。
高効率
EPSグループのデータマネジメント部門、統計解析部門、メディカルライティング部門、臨床開発部門と連携し、お客様の業務を効率的に支援します。
サービス内容
経験豊富な専門スタッフが対応
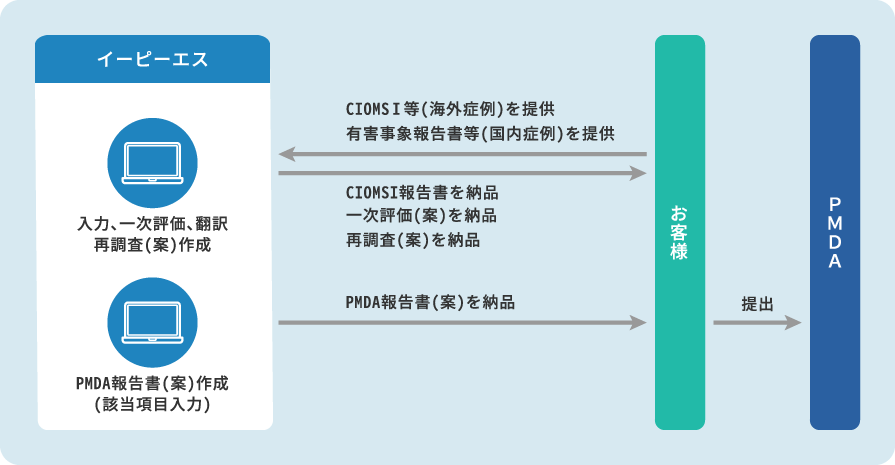
主なサービス
- CIOMS I・MedWatchフォームによる海外情報の一次評価・和訳
- 国内における治験・製造販売後の安全性情報の安全性データベースへの入力・一次評価・英訳
- 文献・学会情報の一次スクリーニング・一次評価
- 英語訳(CIOMS I・MedWatch作成)業務
- モニター、MRへの指示業務サポート
- 治験・製造販売後の安全性情報の各種報告書(案)作成(副作用・感染症症例報告、研究報告、措置報告、不具合有害事象症例報告等)
- 治験・製造販売後の安全性情報の各種定期報告書(案)の作成(未知・非重篤定期報告、安全性定期報告・再審査申請資料の安全性部分、治験安全性年次報告、定期的ベネフィット・リスク評価報告(PBRER)、定期的安全性最新報告(PSUR)、治験安全性最新報告(DSUR)、医薬品リスク管理計画書(RMP)等)
- 感染症定期報告の一次評価・感染症定期報告書(案)作成
- 安全性情報管理業務全般のコンサルティング並びにその他関連業務全般
- イーピーエスの契約専門医師による有害事象のコンサルティング
- 各種報告書作成業務(社内安全性評価委員会用資料(案)作成、海外本社・海外提携会社用報告書(案)作成)
