リスクマネジメント計画書作成
開発~市販後への一貫した安全対策を支援します
最新の規制に則り、科学的かつ効率よいリスク管理計画を提案し、提出版の医薬品リスク管理計画書(RMP)案作成まで、一連の業務に対応します。
EPSの特徴
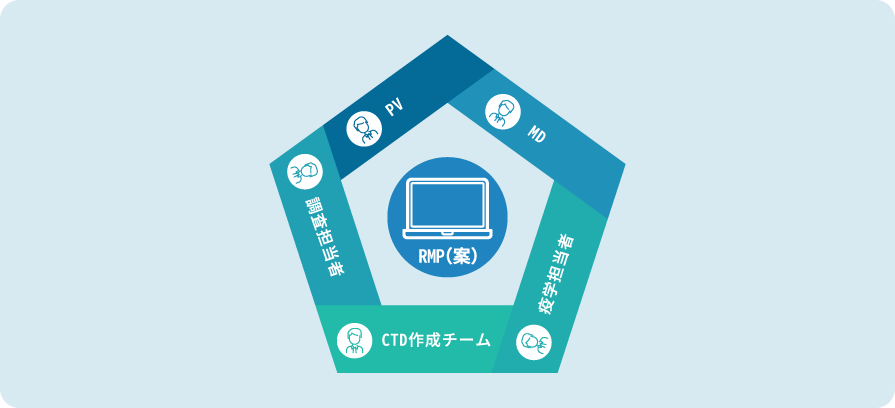
チーム体制
- 治験~市販後までの豊富な業務受託経験を活かして専門の検討チームが対応します。
- 医薬の様々なバックグラウンドを持つ専門スタッフから成る部門横断的検討チームにより必要な検討・提案します。
- 安全性情報担当者、メディカルドクター、疫学担当者、CTD作成チーム、市販後調査担当者、指示作成担当者等がチームに参加します。
柔軟な対応
- 当局対応を見据えたご提案をします。
- 当局との申請前の相談を踏まえてフレキシブルかつきめ細やかな対応・ご提案をします。
サービス内容
- 提出版のRMP案作成
- 海外RMPとのすり合わせ資料作成
- 当該製品の臨床試験資料や類似品目由来の安全性データに基づくリスク検討資料作成
- リスク案設定後に懸念事項を検討・協議のうえ調査の課題(RQ)を検討し、記録作成
- RQをPICOTに当てはめて市販後の監視計画を検討・提案
- 懸念事項に基づいたリスク最小化計画を検討・提案
- リスク用語グルーピング定義の提案
- RMPの定期的見直し
その他サービス
- 翻訳(英訳・和訳)
- 品質管理
