薬事サービス
医薬品・医療機器・再生医療等製品に関する薬事サービスは、当社の経験豊富なプロフェッショナルにお任せください
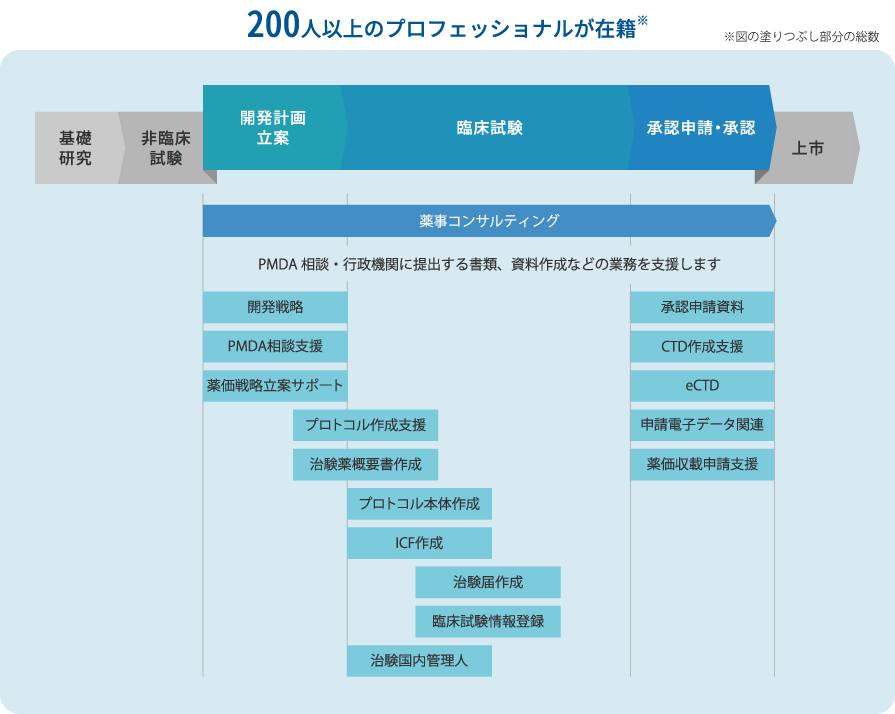
EPSの特徴
フルサポート
当社は、医薬品・医療機器・再生医療等製品に関連する薬事業務をトータルにサポートします。CMC薬事から、医薬品・再生医療等製品の開発初期、治験実施、承認申請、薬価・保険収載にいたるまでの各段階において、コンサルティングや薬事業務、臨床試験の企画立案やPMDA相談に係る各種資料作成、相談内容策定について支援します。 また、日本に拠点を持たない海外企業等に対して、治験国内管理人業務サービスも提供しています。
多様な実績
豊富な薬事業務経験を有するプロフェッショナルが、医薬品・医療機器・再生医療等製品の承認申請において、これまで培ってきた多様な実績をもとに、確実なサポートを提供します。
最新の規制に対応
規制情報、開発・薬事情報を継続的にアップデートし、最新の規制要件に対応したサービスを提供します。
サービス内容
臨床開発計画策定
- 医薬品、再生医療等製品等の開発に関連した事項の相談、検討・策定の支援
- 開発方針、開発戦略
- 臨床データパッケージ、治験デザイン
- PMDA相談の方針(相談ポイント、質問内容)
開発薬事関連
- 開発薬事コンサルティング
- PMDAに対する窓口業務
- 希少疾病用医薬品等および先駆的医薬品等の指定申請支援
- 製造販売承認申請支援(手続き書類作成、適合性調査対応など)
国内治験管理人
- 日本に拠点を持たない海外企業の治験実施における治験の依頼等の治験業務の代行
- 治験届、安全性報告等の規制当局対応
- 適合性書面調査・GCP実地調査への対応等
申請関連
- CTD作成(CTDM1、M2、M3、M4、M5)
- eCTD v4.0 Publishing
- Gateway Submission
- 手順書作成支援(申請対応アセスメント)
- 教育・研修支援
- システム導入・入れ替え支援
医薬品・再生医療等製品薬事
- 薬事全般に関するコンサルティング
- 薬事戦略立案・PMDA相談支援
- 業許可申請等の取得・維持
- 承認・認証申請等支援
- QMS体制構築支援
- 教育研修(医療機器薬機法概論研修、QMS概論研修等)
医薬品・医療機器・再生医療等製品の保険収載サポート
- 薬価戦略立案サポート
- 薬価基準収載希望書作成支援
- 保険戦略コンサルティング
- 保険適用希望書作成支援
